Кристалічна гратка: як побудована тверда речовина, яку ми бачимо щодня
Ми звикли до кришталів солі, блиску металів чи твердості алмазу, але мало хто замислюється, що об’єднує ці такі різні речовини. В основі кожної з них — кристалічна гратка, впорядкована система частинок, від якої залежить усе: блиск, міцність, навіть температура плавлення.
Що таке кристалічна гратка
Уявіть безліч атомів, йонів або молекул, що стоять у строгому порядку, як глядачі на стадіоні. Це і є кристалічна гратка — каркас, який формує структуру твердого тіла.
У кожній точці цього «каркасу» — вузол, де розташована частинка. Відстань між ними, напрямки, симетрія — усе чітко повторюється. Саме завдяки цьому порядок кристали мають сталу форму і властивості.
Якщо структуру порушити — наприклад, розплавити речовину, — гратка руйнується, і тіло стає аморфним, тобто без чіткої форми.
Коли ви тримаєте в руках шматок льоду чи сіль — ви фактично тримаєте мініатюрну тривимірну гратку природи.
Ми можемо глибше зрозуміти матеріал, якщо знаємо, як він «збудований».
Типи кристалічних граток
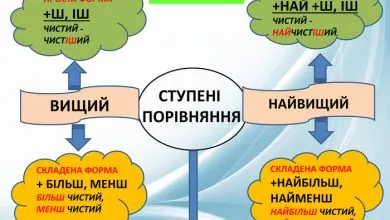
 Не всі гратки однакові. Усе залежить від того, які частинки утворюють вузли і які зв’язки між ними. Є чотири основні типи — кожен зі своїм характером і прикладами.
Не всі гратки однакові. Усе залежить від того, які частинки утворюють вузли і які зв’язки між ними. Є чотири основні типи — кожен зі своїм характером і прикладами.
Йонна гратка
Її складають позитивні й негативні йони, що міцно тримаються електростатичним тяжінням.
Класичний приклад — кухонна сіль (NaCl). Саме цей порядок дає їй твердість, крихкість і здатність розчинятися у воді.
Коли така речовина розплавляється або потрапляє у воду, йони розходяться — тому розчин проводить струм.
Атомна гратка
У вузлах стоять атоми, з’єднані ковалентними зв’язками.
Алмаз — найвідоміший приклад: атоми Карбону утворюють щільну тривимірну сітку, що робить його найтвердішою речовиною у світі.
Інший варіант — графіт. Тут атоми з’єднані шарами, тому графіт м’який і добре проводить струм.
Цей контраст показує, як навіть однаковий елемент може створювати різні матеріали завдяки різній гратці.
Молекулярна гратка
Її утворюють цілі молекули, пов’язані слабкими силами.
Приклади — лід, йод, цукор. Вони мають низьку твердість і легко плавляться, бо молекули тримає лише слабке притягання.
Саме тому лід тане вже при нульовій температурі, а не при тисячах градусів, як алмаз.
Металічна гратка
Тут атоми розташовані щільно, а їхні електрони вільно рухаються всередині структури.
Завдяки цьому метали блищать, проводять струм і легко деформуються, не руйнуючись.
Якщо придивитись до шматка міді чи заліза, можна сказати: це — океан атомів, де електрони плавають, наче риба у воді.
Знання типу гратки допомагає зрозуміти, чому речовини поводяться саме так — тверднуть, плавляться чи проводять струм.
Як гратка впливає на властивості речовин
Будь-яка фізична характеристика — це наслідок внутрішньої будови.
Твердість. У атомній гратці зв’язки найміцніші — звідси алмазна твердість.
Температура плавлення. Йонні речовини (як сіль) плавляться при високих температурах, бо сила між частинками велика.
Розчинність. Молекулярні гратки розчиняються легше через слабкі зв’язки.
Електропровідність. Метали проводять струм, бо електрони вільно рухаються.
Від типу гратки залежить, чи стане речовина електропровідником, крихким кристалом чи гнучким металом.
І що цікаво — навіть незначна зміна розташування частинок може повністю змінити властивості.
Коли наступного разу побачите блиск скла чи сталевий відтінок металу — згадайте, що все це результат невидимого порядку атомів.
Системи кристалічних граток
Кристали можуть бути впорядковані по-різному. Є сім кристалічних систем — від простої кубічної до гексагональної.
Наприклад:
Кубічна — як у кухонній солі.
Гексагональна — як у графіту.
Тетрагональна — властива олову.
Це лише різні способи, як природа «упаковує» частинки, щоб утворити стабільну форму.
Знання цих систем допомагає не лише хімікам — інженери, матеріалознавці та навіть виробники мікрочипів враховують форму гратки, щоб передбачати властивості речовини.
Приклади з життя
Сіль — приклад ідеальної йонної гратки. Саме через неї кристали солі завжди мають однакову форму.
Алмаз — приклад атомної гратки, що робить його неперевершено міцним.
Мідь — металічна гратка, яка дозволяє електронам рухатись і передавати струм.
Лід — молекулярна гратка, завдяки якій вода розширюється при замерзанні.
Ці приклади доводять: структура — це не абстракція, а ключ до розуміння матеріального світу.
 Якщо хочете по-справжньому «бачити» речовини, дивіться на них не очима, а розумінням того, що приховано всередині.
Якщо хочете по-справжньому «бачити» речовини, дивіться на них не очима, а розумінням того, що приховано всередині.
Чому це знання важливе
Поняття кристалічної гратки має практичну цінність у науці й технологіях.
Воно пояснює, як створюються нові сплави, напівпровідники, медичні матеріали, навіть дисплеї.
Іноді зміна лише кількох параметрів у гратці робить речовину суперпровідником або, навпаки, крихким порошком.
Ми користуємось цими знаннями щодня — у смартфонах, авто, будинках. Просто не помічаємо цього.
І саме тут наука зливається з побутом.
Якщо вам цікаво, чому матеріали навколо нас такі різні — спробуйте подивитись на них очима хімії. Це відкриє новий рівень розуміння світу.
Кристалічна гратка — це невидимий порядок, що визначає вигляд і властивості всіх твердих речовин.
Ми стикаємось із нею щодня — у солі, льоді, металі чи навіть у власному телефоні.
І хоч очима її не побачиш, вона — доказ того, що світ побудований з точністю до атома.
Тож наступного разу, коли візьмете в руки склянку води чи шматочок цукру, пам’ятайте: перед вами — гармонія, створена природою у вигляді кристалічної гратки.